محتويات
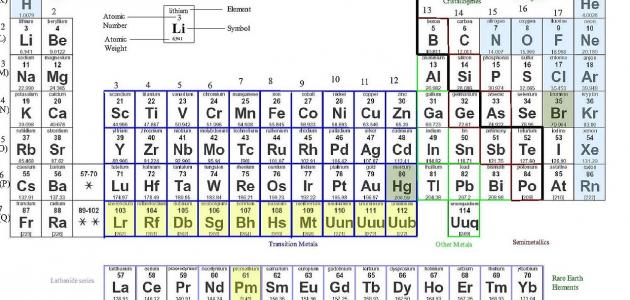
الجدول الدوري
الجدول الدوري يطلق عليه جدول مندليف نسبة إلى العالم الذي قام ببنائه، حيث قام مندليف بترتيب العناصر الكيميائية المعروفة بشكل جدولي، ورتبها حسب خصائصها الكيميائية وحسب تزايد كتلتها، وعبر السنوات تمّ إعادة تخطيط الجدول وإضافة العناصر التي اكتشفت فيما بعد، وقام العالم هنري بإعادة ترتيب العناصر حسب عددها الذري.
يحتوي الجدول الدوري في الوقت الحالي على 118 عنصر كيميائي مقسمة إلى عناصر طبيعية موجودة بالطبيعية وتتمثل بالعناصر من1 إلى 98 والعناصر الأخرى والتي تتمثل من 99 إلى 118 عناصر اكتشفت في المختبرات، والجدول الدوري مهم في توضيح الخواص الكيميائية والفيزيائية للعناصر، ويمكن استخراج العناصر بسهولة.
خصائص عناصر الجدول الدوري
الفلزات أو المعادن
- الخواص الفيزيائية: ويقصد بها الخاصية الطبيعية التي تمتاز بها دون تدخل بشري، وتشمل هذه الخواص على:
- اللمعان.
- البريق.
- موصل للكهرباء والحرارة بشكل جيد.
- جميع عناصر الفلزات صلبة ماعدا عنصر الزئبق فهو سائل لزج.
- تحتاج إلى درجة انصهار عالية.
- كثافتها عالية.
- قابلة للطرق والسحب.
- الخواص الكيميائية: تتميز الفلزات بأنها:
- تتأكل وتصدأ بسرعة مثل الحديد والفضة.
- تفقد إلكتروناتها بسهولة.
اللافلزات أو اللامعادن
- الخواص الفيزيائية:
- لا تلمع.
- غير براقة.
- هشة تتكسر بسرعة.
- لا توصل الحرارة والكهرباء.
- كثافتها قليلة.
- درجة انصهارها قليلة.
- الخواص الكيميائية: تميل إلى كسب الإلكترونات بسهولة.
أشباه الفلزات
- الخواص الفيزيائية:
- صلبة.
- منها ما يلمع ومنها ليس لديه لمعان.
- قابلة للطرق والسحب.
- الخواص الكيماوية: يمكن أن توصل الحرارة والكهرباء ولكن ليس بجودة المعادن.
مجموعات الجدول الدوري
يقسم الجدول الدوري إلى مجموعتين A وB، كل مجموعة تشكل عدة مجموعات فرعية، تضم عدداً من العناصر المتشابهة في خواصها الفيزيائية والكيميائية، ويمكن تلخيص المجموعات كما يلي:
عناصر المجموعة A
- المجموعة الأولى: يطلق على عناصرها بالمعادن القلوية
- تضم العناصر (Li, Na, K, Cs, Fr).
- تتميز عناصر المجموعة بحالة الأكسدة الاحادية.
- المجموعة الثانية: يطلق عليها بالمعادن القلوية الأرضية.
- تضم العناصر:(Be, Mg, Ca, Sr, Ba, Ra).
- تتميز بحالة الأكسدة الثنائية.
- المجموعة الثالثة:
- تضم العناصر: B, Al, Ga, In, Tl.
- تتيمز بحالة الأكسدة الثلاثية.
- المجموعة الرابعة:
- تضم العناصر C, Si, Ge, Sn, Pb.
- تتميز بحالة الأكسدة الرباعية.
- المجموعة الخامسة:
- تضم العناصر (N. P, As, Sb, Bi).
- تتيمز بحالة الأكسدة الثلاثية والخماسية.
- المجموعة السادسة:
- تضم عناصر (O, S, Se, Te, Po ).
- تتيمز بحالة الثنائية السالبة، والسداسية.
- المجموعة السابعة:
- تسمى مجموعة الهالوجينات.
- تضم العناصر F, Cl, Br, I, At.
- المجموعة الثامنة:
- تسمى بالغازات الخاملة.
- تضم العناصر: He, Ne, Ar, Kr, Xe, Rn.
- الحالة التأكسية لها صفر، ويعود ذلك لإمتلاء غلافها بالإلكترونات.
عناصر المجموعة B
هذه المجموعة تشمل كل العناصر الواقعة في وسط الجدول الدوري، وتتشابة جميعها بالخواص الفيزيائية والكيميائية.
معلومات عن الجدول الدوري
- يقسم الجدول الدوري إلى مجموعات ودورات وقطاعات، وكل تقسيم له مميزات خاصة به.
- عناصر المجموعة الواحدة تتميز بنفس الخواص الكيميائية والفيزيائية.
- يقسم الجدول الدوري حسب عدد العناصر الى دورتين وكل دورة نمثل بداية غلاف إلكتروني مختلف.
- يمكن معرفة موقع العنصر من التوزيع الإلكتروني.
- العناصر المقسمة إلى دورات يقل حجمها الذري بزيادة العدد الذري لها.